Электролиз (греч. elektron - янтарь + lysis - разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H 2 SO 4) восстанавливается водород из молекул кислоты: 2H + - 2e = H 2
Анод
К аноду притягиваются анионы - отрицательно заряженные ионы: SO 4 2- , PO 4 3- , Cl - , Br - , I - , F - , S 2- , CH 3 COO - .

При электролизе кислородсодержащих анионов: SO 4 2- , PO 4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO 2 .
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO 3) 2 , AlBr 3 , NaF, FeI 2 , CH 3 COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H 2 O → H 2 + Cl 2 + NaOH
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно:) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO 4:
CuSO 4 + H 2 O → Cu + O 2 + H 2 SO 4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl 3 → Al + Cl 2
LiBr → Li + Br 2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
Химические реакции, сопровождающиеся переносом электронов () делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав .
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита , и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод (анод ) притягивает отрицательно заряженные частицы (анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода , которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей . Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н 2 О . В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H 2 O +2ē → H 2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н +) , то на катоде восстанавливается (разряжается ) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться ) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2H + 2 O +2ē → H 2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H 2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl 2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются . А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H 2 O -2 – 4ē → O 2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H 2 O -2 – 4ē → O 2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O 2 0 + 2H 2 O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH 3 C +3 OO – – 2ē → 2C +4 O 2 + CH 3 -CH 3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди . На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды :
Анод (+): 2H 2 O -2 – 4ē → O 2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO 4 + 2H 2 O -2 → 2Cu 0 + 2H 2 SO 4 + O 2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород :
Катод (–):
На аноде окисляются хлорид-ионы :
Анод (+): 2Cl – – 2ē → Cl 2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2H + 2 O +2NaCl – → H 2 0 + 2NaOH + Cl 2 0
Следующий пример карбоната калия.
На катоде восстанавливается водород из воды :
Катод (–): 2H + 2 O +2ē → H 2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода :
Анод (+): 2H 2 O -2 – 4ē → O 2 0 + 4H +
Таким образом, при ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H 2 + O -2 → 2H 2 0 + O 2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь :
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора :
Анод (+): 2Cl – – 2ē → Cl 2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl 2 – → Cu 0 + Cl 2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды :
Катод (–): 2H + 2 O +2ē → H 2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода :
Анод (+): 4 O -2 H – – 4ē → O 2 0 + 2H 2 O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H 2 + O -2 → 2H 2 0 + O 2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия . На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора :
Анод (+): 2Cl – – 2ē → Cl 2 0
расплава хлорида натрия :
2Na + Cl – → 2Na 0 + Cl 2 0
Еще один пример: электролиз расплава гидроксида натрия . На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы :
Анод (+): 4OH – – 4ē → O 2 0 + 2H 2 O
Суммарное уравнение электролиза расплава гидроксида натрия :
4Na + OH – → 4Na 0 + O 2 0 + 2H 2 O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na 3 плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al 2 O 3 = Al 3+ + AlO 3 3-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы :
Анод (+): 4AlO 3 3 – – 12ē → 2Al 2 O 3 + 3O 2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al 2 О 3 = 4Al 0 + 3О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О 2 0 = C +4 O 2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
$NaCl→Na^{+}+Cl^{-}.$
Под действием электрического тока катионы $Na^{+}$ движутся к катоду и принимают от него электроны:
$Na^{+}+ē→{Na}↖{0}$ (восстановление).
Анионы $Cl^{-}$ движутся к аноду и отдают электроны:
$2Cl^{-}-2ē→{Cl_2}↖{0}$ (окисление).
Суммарное уравнение процессов:
$Na^{+}+ē→{Na}↖{0}|2$
$2Cl^{-}-2ē→{Cl_2}↖{0}|1$
$2Na^{+}+2Cl^{-}=2{Na}↖{0}+{Cl_2}↖{0}$
$2NaCl{→}↖{\text"электролиз"}2Na+Cl_2$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов ) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:

Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2+Cl_2+2OH^{-}$.
Учитывая присутствие ионов $Na^{+}$ в растворе, составляем молекулярное уравнение:
2) Анод растворимый (например, медный):
$NaCl=Na^{+}+Cl^{-}$.
Если анод растворимый, то металл анода будет окисляться:
$Cu^{0}-2ē=Cu^{2+}$.
Катионы $Cu^{2+}$ в ряду напряжений стоят после ($Н^{+}$), по этому они и будут восстанавливаться на катоде.

Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде :

$Cu^{2+}+2ē=Cu^{0}|2$
$2H_2O-4ē=O_2+4H^{+}|1$
Суммарное ионное уравнение:
$2Cu^{2+}+2H_2O=2Cu^{0}+O_2+4H^{+}$
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^{2-}$ в растворе:

Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:

$2H_2O+2ē=H_2+2OH^{-}|2$
$4OH^{-}-4ē=O_2+2H_2O|1$
Суммарное ионное уравнение:
$4H_2O+4OH^{-}=2H_2+4OH^{-}+O_2+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text"электролиз"}2H_2+O_2$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Напомним, что на катоде протекают процессы восстановления, на аноде - процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H 2:
2H 2 O + 2e → H 2 0 + 2OH - .
Например, в случае электролиза растворов NaNO 3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H 2 .
Например, в случае электролиза раствора H 2 SO 4 .
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F -), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl - - 2e → Cl 2 .
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды - почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH - и H + не могут стоять по разные стороны одного уравнения; 2) H 2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H 2), а на аноде протекают только процессы окисления.
4OH - - 4e → O 2 + 2H 2 O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H 2 O - 4e → O 2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO 2 и удвоение остатка углеродной цепи:
2R-COO - - 2e → R-R + 2CO 2 .
Примеры:
1. Раствор NaCl
NaCl → Na + + Cl -
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К:
2Na + (в растворе)
А:
2Cl - - 2e → Cl 2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl - + 2H 2 O → H 2 0 + 2Na + + 2OH - + Cl 2 . Соединяем катионы и анионы:
2NaCl + 2H 2 O → H 2 0 + 2NaOH + Cl 2 .
2. Раствор Na 2 SO 4
Расписываем диссоциацию на ионы:
Na 2 SO 4 → 2Na + + SO 4 2-
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К:
2H 2 O + 2e → H 2 0 + 2OH -
А:
2H 2 O - 4e → O 2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К:
4H 2 O + 4e → 2H 2 0 + 4OH -
А:
2H 2 O - 4e → O 2 0 + 4H + .
6H 2 O → 2H 2 0 + 4OH - + 4H + + O 2 0 .
4OH- и 4H+ соединяем в 4 молекулы H 2 O:
6H 2 O → 2H 2 0 + 4H 2 O + O 2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H 2 O и получаем итоговое уравнение гидролиза:
2H 2 O → 2H 2 0 + O 2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl 2
Расписываем диссоциацию на ионы:
CuCl 2 → Cu 2+ + 2Cl -
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К
:
Cu 2+ + 2e → Cu 0
A:
2Cl - - 2e → Cl 2
CuCl 2 → Cu 0 + Cl 2 .
4. Раствор CuSO 4
Расписываем диссоциацию на ионы:
CuSO 4 → Cu 2+ + SO 4 2-
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К:
Cu 2+ + 2e → Cu 0
A:
SO 4 2- (в растворе)
2H 2 O - 4e → O 2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO 4 2- 1:1.
К:
2Cu 2+ + 4e → 2Cu 0
A:
2SO 4 2- (в растворе)
2H 2 O - 4e → O 2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO 4 2- + 2H 2 O → 2Cu 0 + O 2 + 4H + + 2SO 4 2- .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO 4 + 2H 2 O → 2Cu 0 + O 2 + 2H 2 SO 4 .
5. Раствор NiCl 2
Расписываем диссоциацию на ионы:
NiCl 2 → Ni 2+ + 2Cl -
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К
:
Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
A:
2Cl - - 2e → Cl 2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К:
Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (в растворе)
A:
4Cl - - 4e → 2Cl 2
Замечаем, что согласно формуле NiCl 2 , соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl 2 . Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl - + 2H 2 O → Ni 0 + H 2 0 + 2OH - + Ni 2+ + 2Cl 2 .
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl 2 + 2H 2 O → Ni 0 + H 2 0 + Ni(OH) 2 + 2Cl 2 .
6. Раствор NiSO 4
Расписываем диссоциацию на ионы:
NiSO 4 → Ni 2+ + SO 4 2-
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К:
Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
A:
SO 4 2- (в растворе)
2H 2 O - 4e → O 2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К:
Ni 2+ + 2e → Ni 0
2H 2 O + 2e → H 2 0 + 2OH -
Ni 2+ (в растворе)
A:
2SO 4 2- (в растворе)
2H 2 O - 4e → O 2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + Ni 2+ + 2OH - + H 2 0 + O 2 0 + 2SO 4 2- + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO 4 + 4H 2 O → Ni 0 + Ni(OH) 2 + H 2 0 + O 2 0 + 2H 2 SO 4 .
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH - с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO 4 2- + 2H 2 O + 2H 2 O → Ni 0 + 2OH - + H 2 0 + O 2 0 + SO 4 2- + 4H + .
Ni 2+ + SO 4 2- + 4H 2 O → Ni 0 + H 2 0 + O 2 0 + SO 4 2- + 2H + + 2H 2 O.
Итоговое уравнение:
NiSO 4 + 2H 2 O → Ni 0 + H 2 0 + O 2 0 + H 2 SO 4 .
7. Раствор CH 3 COONa
Расписываем диссоциацию на ионы:
CH 3 COONa → CH 3 COO - + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К:
2Na + (в растворе)
2H 2 O + 2e → H 2 0 + 2OH -
А:
2CH 3 COO - - 2e → CH 3 -CH 3 + CO 2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH 3 COO - + 2H 2 O → 2Na + + 2OH - + H 2 0 + CH 3 -CH 3 + CO 2
Соединяем катионы и анионы:
2CH 3 COONa + 2H 2 O → 2NaOH + H 2 0 + CH 3 -CH 3 + CO 2 .
8. Раствор H 2 SO 4
Расписываем диссоциацию на ионы:
H 2 SO 4 → 2H + + SO 4 2-
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К
:
2H + +2e → H 2
A:
2H 2 O - 4e → O 2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К
:
4H + +4e → 2H 2
A:
2H 2 O - 4e → O 2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H 2 O → 2H 2 + O 2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H 2 O:
2H 2 O → 2H 2 + O 2 .
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH -
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К:
Na+ (в растворе)
2H 2 O + 2e → H 2 0 + 2OH -
А:
4OH - - 4e → O 2 + 2H 2 O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К:
Na + (в растворе)
4H 2 O + 4e → 2H 2 0 + 4OH -
А:
4OH - - 4e → O 2 + 2H 2 O
Суммируем левые и правые части процессов:
4H 2 O + 4OH - → 2H 2 0 + 4OH - + O 2 0 + 2H 2 O
Сокращая 2H 2 O и ионы OH - , получаем итоговое уравнение электролиза:
2H 2 O → 2H 2 + O 2 .
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H 2 O → 2H 2 + O 2 .
Электролиз
Процессы, протекающие при электролизе противоположны процессам, идущим при работе гальванического элемента. Если при работе гальванического элемента, энергия самопроизвольно протекающей окислительно0восстановительной реакции превращается в электрическую энергию, то при электролизе химическая реакция происходит за счет энергии электрического тока.
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Электролиз проводится в электролизерах, основными составными частями которых являются два электрода, погруженные в ионный проводник (электролит) и подключенные к клеммам источника постоянного тока.
Электрод, соединенный с отрицательным полюсом источника тока называется катодом, а с положительным – анодом .
При подаче напряжения на катоде происходят процессы восстановления, а на аноде – процессы окисления.
Аноды бывают нерастворимые (из угля, графита, платины и иридия) и растворимые (из меди, серебра, цинка, кадмия и никеля). Растворимый анод подвергается окислению, т.е. посылает электроны во внешнюю цепь.
Электролиз расплава протекает по следующей схеме:
1. анионы, образовавшиеся при плавлении электролита в порядке возрастания их электродных потенциалов (j 0)
2. катионы восстанавливаются на катоде в порядке убывания их j 0 .
Например, 2NaCl ® 2Na + Cl 2 K (-) 2Na + + 2e = 2Na 0
расплав A (+) 2Cl - - 2e = Cl 2
При определении продуктов электролиза водных растворов электролитов необходимо учитывать возможность участия в окислительно-восстановитель-ных реакциях молекул воды, материал из которого изготовлен анод, природу ионов и условия электролиза.
Таблица 3 - Общие правила написания уравнений электролиза
водных растворов электролитов
1. Электролиз раствора NaCl (анод инертный)
К (-) : Na + ; H 2 O
H 2 O + 2e ® H 2 + 2OH -
А (+) : Cl - ; H 2 O
2 Cl - - 2е ® Cl 2
2H 2 O +2NaCl эл. ток H 2 + Cl 2 + 2NaOH
В результате на катоде выделяется Н 2 , на аноде Cl 2 , а в катодном пространстве электролизера накапливается NaOH
2. Электролиз раствора ZnSO 4 (анод инертный)
К (-) : Zn 2+ ; H 2 O
Zn 2+ + 2е ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
А (+) : 2H 2 O – 4e ® O 2 + 4H +
Zn 2+ +4H 2 O ® Zn + H 2 + O 2 + 2OH - + 4H +
После сокращения молекул Н 2 О и добавления в обе части уравнения ионов SO 4 2- , получим молекулярное уравнение электролиза:
ZnSO 4 + 2H 2 O эл. ток Zn + H 2 + O 2 + H 2 SO 4
3. Электролиз раствора K 2 SO 4 (анод инертный)
К (-) : К + ; H 2 O
H 2 O + 2e ® H 2 + 2OH -
А (+) : SO 4 2- ; H 2 O
2H 2 O – 4e ® O 2 + 4H +
2Н 2 О + 2е эл. ток О 2 + 2Н 2
т.е. электролиз раствора сульфата калия сводится к разложению воды. Концентрация соли в растворе увеличивается.
4. Электролиз раствора ZnSO 4 с анодом из цинка.
К (-) : Zn 2+ ; H 2 O
Zn 2+ + 2е ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
А (+) : Zn 0 ; H 2 O
Zn 0 -2е ® Zn 2+
Zn 0 + Zn 2+ ® Zn 2+ + Zn 0
Т.е. электролиз раствора ZnSO 4 с анодом из цинка сводится к переносу цинка с анода на катод..
Между количеством вещества, выделившегося на электродах при электролизе, количеством прошедшего через раствор электричества и временем электролиза существуют зависимости, выражаемые законом Фарадея.
Первый закон Фарадея: масса вещества, выделившегося или растворившегося на электродах, прямо пропорционально количеству прошедшего через раствор электричества :
m = --------- ; где m – масса вещества, выделившегося на электродах,
FМ Э – молярная масса эквивалента вещества, г/моль,
I – сила тока, А;
t - время электролиза, сек.;
F – постоянная Фарадея (96500 Кл/моль).
Второй закон Фарадея: при определенном количестве электричества, прошедшего через раствор, отношение масс прореагировавших веществ равно отношению молярных масс их химических эквивалентов:
Соnst
МЭ 1 МЭ 2 МЭ 3
Для выделения или растворения 1 моль эквивалента любого вещества необходимо пропустить через раствор или расплав одно и тоже количество электричества, равное 96 500 Кл. Эта величина получила название постоянной Фарадея.
Количество вещества, выделившегося на электроде при прохождении 1Кл электричества, называется его электрохимическим эквивалентом (ε).
ε =. ------- , где ε - электрохимический
F эквивалент
Мэ – молярная масса эквивалента
элемента (вещества); , г/моль
F – постоянная Фарадея, Кл/моль.
Таблица 4 - Электрохимические эквиваленты некоторых элементов
| катион | Мэ, г/моль | ε , мг | Анион | Мэ, г/моль | ε , мг |
| Ag + Al 3+ Au3+ Ba 2+ Ca 2+ Cd 2+ Cr 3+ Cu 2+ Fe 2+ Fe 3+ H + K + Li + Mg 2+ Mn 2+ Na + Ni 2+ Pb 2+ Sn 2+ Sr 2+ Zn 2+ | 107,88 8,99 65,70 58,70 20,04 56,20 17,34 31,77 27,92 18,61 1,008 39,10 6,94 12,16 27,47 22,90 29,34 103,60 59,40 43,80 32,69 | 1,118 0,93 0,681 0,712 0,208 0,582 0,179 0,329 0,289 0,193 0,0105 0,405 0,072 0,126 0,285 0,238 0,304 1,074 0,616 0,454 0,339 | Br - BrO 3 - Cl - ClO 3 - HCOO - СН 3 СОО - CN - CO 3 2- C 2 O 4 2- CrO 4 2- F - I - NO 3 - IO 3 - OH - S 2- SO 4 2- Se 2- SiO 3 2- | 79,92 127,92 35,46 83,46 45,01 59,02 26,01 30,00 44,50 58,01 19,00 126,42 174,92 62,01 17,00 16,03 48,03 39,50 38,03 | 0,828 1,326 0,368 0,865 0,466 0,612 0,270 0,311 0,456 0,601 0,197 1,315 1,813 0,643 0,177 0,170 0,499 0,411 0,395 |
Процессы окисления и восстановления лежат в основе работы таких химических источников тока, как аккумуляторы.
Аккумуляторами называются гальванические элементы, в которых возможны обратимые процессы зарядки и разрядки, совершаемые без добавления участвующих в их работе веществ.
Для восстановления израссходованной химической энергии аккумулятор заряжают, пропуская ток от внешнего источника. При этом на электродах протекают электрохимические реакции, обратные тем, что имели место при работе аккумулятора в качестве источника тока.
Наиболее распространенными в настоящее время являются свинцовые аккумуляторы, в которых положительным электродом служит диоксид свинца PbO 2 , а отрицательным – металлический свинец Pb.
В качестве электролита применяют 25-30% раствор серной кислоты, поэтому свинцовые аккумуляторы называют еще кислотными.
Процессы, протекающие при разрядке и зарядке аккумулятора, суммарно могут быть представлены: разрядка
Pb 0 + Pb +4 O 2 + 4Н + + 2SO 4 2- « 2Pb 0 +2SO 4 2- + 2H 2 O
Помимо свинцового аккумулятора в практике находят применение щелочные аккумуляторы: никель-кадмиевые, никель-железные.
Таблица 5 – Виды аккумуляторов







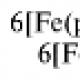


Самые сытные продукты, помогающие есть меньше
Составить предложения на английском языке
Паразитическая цивилизация породила элиту-паразита
В какое время можно восполнять пропущенные намазы
Тьютор для ребенка с рас: правовая норма и реальность