Открытие колебательных
химических реакций
В 2001 г. исполнилось 50 лет открытию Б.П.Белоусовым автоколебательной химической реакции, благодаря которой появилась возможность наблюдать периодические изменения концентрации реагентов и распространение автоволн в гомогенной химической системе.
«Вы смотрите на стакан с красно-лиловой
жидкостью, а он вдруг становится ярко-синим. А
потом снова красно-лиловым. И снова синим. И вы
невольно начинаете дышать в такт колебаниям. А
когда жидкость налита тонким слоем, в ней
распространяются волны изменения окраски.
Образуются сложные узоры, круги, спирали, вихри,
или все приобретает совершенно хаотический вид»
– так описывает эту гомогенную колебательную
химическую реакцию профессор С.Э.Шноль,
сыгравший далеко не последнюю роль в спасении ее
от незаслуженного забвения.
В 1958 г. в Институте химической физики АН СССР
проходил семинар. Докладчик, молодой биофизик
Шноль, рассказывая о биоритмах, развивал свою
гипотезу, что биологическими часами управляют
химические реакции. Для подтверждения этого
нужны были реальные примеры химических
колебаний, и докладчик обратился к аудитории с
вопросом, не может ли кто-нибудь их указать. Таких
примеров никто не привел, более того, были
высказаны некоторые соображения о
принципиальной невозможности концентрационных
колебаний в химических реакциях. Вопрос
разрешился неожиданным образом. Уже после
закрытия семинара, когда почти все участники
разошлись, к докладчику подошел молодой аспирант
и сообщил, что химические колебания изучал его
дядя пять-шесть лет назад.
Такая непростая история
Выснилось, что Шноль давно искал этого
человека. Дядя, а точнее двоюродный дед аспиранта
Бориса Смирнова, Борис Павлович Белоусов еще в 1951
г. открыл колебания концентраций окисленной и
восстановленной форм церия в реакции
взаимодействия лимонной кислоты с броматом
калия, катализируемой ионами церия. Раствор
регулярно менял свою окраску от бесцветной к
желтой, обусловленной наличием церия(IV), затем
снова к бесцветной из-за церия(III) и т. д. Белоусов
провел достаточно подробное исследование этой
реакции и, в частности, выяснил, что период
колебаний существенно уменьшается с повышением
кислотности среды и температуры.
Реакция к тому же оказалась удобной для
лабораторных исследований. Колебания можно было
легко наблюдать визуально, а их период находился
в пределах 10–100 с.
Действительно, современная история исследований
колебательных химических реакций в жидкой фазе
началась в 1951 г. с открытия Белоусова, хотя для
самого автора все проходило далеко не так гладко.
Его статья с описанием колебательной реакции
дважды отклонялась редакциями академических
химических журналов. Лишь в 1958 г. ее сокращенный
вариант вышел в малоизвестном «Сборнике
рефератов по радиационной медицине».
Сейчас представляется, что основной причиной
неприятия химиками этого феномена послужило
широко распространенное мнение о том, что вдали
от положения равновесия концентрационные
колебания запрещены вторым законом
термодинамики.
В то время как химики, к которым присоединились и
биохимики, дружно отвергали химические
колебания, последние продолжали привлекать
внимание математиков и физиков,
интересовавшихся биологией. В 1952 г. появилась
статья английского ученого А.М.Тьюринга
«Химические основы морфогенеза», в которой он
сообщал, что сочетание химических колебаний с
диффузией молекул может приводить к появлению
устойчивых пространственных структур, области
высоких и низких концентраций которых
чередуются. Тьюринг поставил перед собой сугубо
теоретическую задачу: могут ли в реакторе в
условиях химической реакции образовываться
устойчивые конфигурации промежуточных
продуктов? И дал положительный ответ, создав
определенную математическую модель процесса.
Должного значения этой работе тогда не придали,
тем более что ни сам Тьюринг, ни его коллеги не
могли знать о работе Белоусова и его тщетных
попытках ее опубликовать.
В 1955 г. бельгийский физик и физикохимик, автор
теории термодинамики необратимых процессов,
И.Р.Пригожин показал, что в открытой системе
около стационарного состояния, достаточно
удаленного от химического равновесия, возможны
химические колебания. Именно он обратил внимание
западной научной общественности на работы
советских ученых. В результате некоторые
колебательные гетерогенные химические реакции,
открытые еще в конце XIX в., получили широкое
признание. Именно их стали рассматривать как
аналоги ряда периодических процессов, например
«биологических часов».
Исследователям стало ясно, что второй закон
термодинамики не нарушается в живых системах и
не мешает их сложному поведению и эволюции. Но
для существования жизни или любой ее физической
или химической модели необходимо, чтобы система
достаточно долго находилась вдали от
термодинамического равновесия. И гомогенные
химические системы могли стать удобной моделью
для изучения таких процессов.
Именно в это время профессор Шноль получил
«рецепт» колебательной реакции у Белоусова и
предложил ему сотрудничество, от которого тот
категорически отказался, хотя и не возражал
против продолжения этих работ.
В 1961 г. академик И.Е.Тамм, крупнейший
физик-теоретик, решил «проинспектировать»
состояние дел на недавно созданной кафедре
биофизики физического факультета МГУ. Шноль
продемонстрировал ему реакцию Белоусова. Вот как
рассказывает об этом сам Шноль: «Игорь
Евгеньевич увидел и надолго остановился,
наслаждался. Потом сказал: “Ну, знаете что,
братцы, имея такую реакцию, можете не
волноваться: на много лет хватит загадок и
работы”. Слова Игоря Евгеньевича подействовали
на многих. Реакцией решил заняться Толя
Жаботинский из первого нашего выпуска,
потомственный, как он сам про себя говорил,
физик».
Шноль поддержал молодого ученого и предложил
аспиранту А.М.Жаботинскому начать исследования
механизма реакции Белоусова, которыми тот с
энтузиазмом и занялся. «Замечательной
особенностью работ Жаботинского и
образовавшейся вокруг него группы сотрудников,
– вспоминает Шноль, – было сочетание
химического эксперимента, методов физической
регистрации и построение математических
моделей. В этих моделях – системах
дифференциальных уравнений – кинетические
константы подставлялись из экспериментальных
данных. После этого можно было сравнивать
экспериментальные записи колебаний с кривыми,
которые получались при компьютерном
моделировании».
Позже эти работы были продолжены в лаборатории
физической биохимии Института биологической
физики АН СССР. Вспоминает доктор
физико-математических наук В.А.Вавилин: «Перед
Жаботинским и мной, студентом-дипломником
кафедры биофизики физического факультета МГУ,
стояла задача обнаружить колебания в системе
Брея с помощью непрерывной
спектрофотометрической регистрации
концентрации йода. Интерес вызывало и сравнение
механизмов реакций Белоусова и Брея». Дело в том,
что колебания в жидкофазной химической системе
открыл в 1921 г. У.Брей. При разложении пероксида
водорода йодатом калия он обнаружил
периодическое выделение кислорода из системы,
зафиксировав несколько периодов сильно
затухающих колебаний. Некоторые исследователи,
ссылаясь на интенсивное газовыделение,
высказывали сомнения в гомогенном характере
этой реакции, поэтому существование
колебательной реакции именно в гомогенной среде
опыты Брея так и не доказали.
Между двумя периодическими реакциями Брея и
Белоусова сразу же возникла своего рода
«конкуренция». Тем не менее легкое
воспроизведение результатов и красивые
визуальные эффекты, наблюдаемые в реакции
Белоусова, способствовали появлению большого
числа ее приверженцев, и она получила широкую
известность (позднее ее назвали реакцией
Белоусова–Жаботинского, или БЖ-реакцией, а
периодическую реакцию Брея – реакцией
Брея–Либавского). По мнению Вавилина, открытие и
изучение в ходе реакции Белоусова автоколебаний
и автоволн С.Э.Шнолем, А.М.Жаботинским,
В.И.Кринским, А.Н.Заикиным, Г.Р.Иваницким – едва ли
не самая блестящая страница фундаментальной
отечественной науки в послевоенный период.
Кстати, Жаботинскому принадлежит одна из первых
книг в этой области.
Быстрое и успешное изучение реакции
Белоусова–Жаботинского сработало в науке как
спусковой крючок: сразу вспомнили, что и раньше
были известны процессы подобного рода. Однако
ценность реакции Белоусова, по мнению профессора
Б.В.Вольтера, кстати, впервые отметившего
значимость колебательных реакций и в
промышленных химико-технологических процессах,
состояла вовсе «не в приоритете, а в простоте и
наглядности эксперимента, наконец, в
результатах, полученных с помощью этого
интересного превращения А.М.Жаботинским,
А.Н.Заикиным, Е.Е.Сельковым и др.». Если же
обратиться к прошлому, то первые описания
колебаний в концентрационных системах относятся
к XIX в.
Исследования концентрационных
колебаний до открытия
реакции Белоусовым
Оказалось, что одна из первых публикаций по
химическим колебаниям относится к 1828 г. В ней
Т.Фехнер изложил результаты исследования
колебаний электрохимической реакции. В 1833 г.
В.Гершель публикует подобное исследование
колебаний каталитической гетерогенной реакции.
Наиболее интересна работа М.Розеншельда,
относящаяся к 1834 г. Ее автор совершенно случайно
заметил, что небольшая колба, содержащая немного
фосфора, в темноте испускает довольно
интенсивный свет. В самом факте свечения фосфора
не было ничего удивительного, но то, что это
свечение регулярно повторялось каждую седьмую
секунду, было интересно. В публикации
Розеншельда приводится детальное исследование
мерцаний колбы. Сорок лет спустя эти
эксперименты с «мерцающей колбой» продолжил
француз М.Жубер (1874). Ему удалось в пробирке
наблюдать периодическое образование
«светящихся облаков». Еще через двадцать лет
также немецкий ученый А.Центнершвер исследовал
влияние давления воздуха на периодические
вспышки фосфора. В его экспериментах период
вспышек начинался с 20 с и уменьшался с понижением
давления. В то же время в Англии химики Т.Торп и
А.Таттон наблюдали в запаянном стеклянном сосуде
периодические вспышки реакции окисления
триоксида фосфора.
Особенно яркая страница в истории химических
колебаний связана с так называемыми кольцами
Лизеганга. В 1896 г. немецкий химик Р.Лизеганг,
экспериментируя с фотохимикатами, обнаружил, что
если капнуть ляписом на стеклянную пластину,
покрытую желатиной, содержащей хромпик, то
продукт реакции, выпадая в осадок, располагается
на пластинке концентрическими окружностями.
Лизеганг увлекся этим явлением и почти полвека
занимался его исследованием. Нашлось и
практическое его применение. В прикладном
искусстве кольца Лизеганга использовали для
украшения различных изделий с имитацией яшмы,
малахита, агата и т. п. Сам Лизеганг предложил
технологию изготовления искусственного жемчуга.
И все-таки открытие Лизеганга, имевшее большой
резонанс в научных химических кругах, не было
первым. И до него изучали химические волны, а в 1855
г. вышла книга Ф.Рунге, в которой были собраны
многочисленные примеры таких экспериментов.
Перечень подобных примеров можно продолжить.
Вслед за указанными были открыты колебательные
реакции на границе раздела двух фаз. Из них
наиболее известны реакции на границе
металл–раствор, получившие специфические
названия – «железный нерв» и «ртутное сердце».
Первая из них – реакция растворения железа
(проволоки) в азотной кислоте – получила свое
название из-за внешнего сходства с динамикой
возбужденного нерва, замеченного В.Ф.Оствальдом.
Вторая, вернее один из ее вариантов, – реакция
разложения Н 2 О 2 на поверхности
металлической ртути. В реакции происходит
периодическое образование и растворение пленки
оксида на поверхности ртути. Колебания
поверхностного натяжения ртути обусловливают
ритмические пульсации капли, напоминающие
биение сердца. Но все эти реакции не привлекали
особенного внимания химиков, поскольку
представления о ходе химической реакции были еще
достаточно смутными.
Лишь во второй половине XIX в. возникли
термодинамика и химическая кинетика, положившие
начало специфическому интересу к колебательным
реакциям и методам их анализа. И в то же время
именно развитие равновесной термодинамики
послужило на первых порах тормозом при изучении
подобных процессов. Дело, видимо, было в «инерции
предыдущего знания». По словам профессора Шноля,
«не мог образованный человек представить себе в
беспорядочном тепловом движении огромного числа
молекул макроскопическую упорядоченность: все
молекулы то в одном, то в другом состоянии! Будто
признать существование вечного двигателя. Этого
быть не может. И в самом деле не может этого быть.
Не может быть вблизи состояния равновесия, а
только его и рассматривала термодинамика тех
лет. Однако никаких ограничений на сложные, в том
числе колебательные, режимы нет для
неравновесных химических систем, когда реакции
еще не завершились, и концентрации реагентов не
достигли равновесного уровня. Но это
обстоятельство ускользало от внимания химиков…
Потребовалось чрезвычайное интеллектуальное
напряжение, чтобы вырваться из “железных оков
полного знания” и исследовать поведение систем
вдали от равновесия».
Тем не менее уже в 1910 г. итальянец А.Лотка на
основе анализа системы дифференциальных
уравнений предсказал возможность колебаний в
химических системах. Однако первые
математические модели соответствовали только
затухающим колебаниям. Лишь через 10 лет Лотка
предложил систему с двумя последующими
автокаталитическими реакциями, и в этой модели
колебания уже могли быть незатухающими.
Однако позиции физиков и химиков здесь
разошлись. Одно из наиболее ярких достижений
физики и математики XX в. – создание теории
колебаний. Большие, общепризнанные заслуги
принадлежат здесь советским физикам. В 1928 г.
аспирант А.А.Андронов, будущий академик, выступил
на съезде физиков с докладом «Предельные циклы
Пуанкаре и теория автоколебаний».
В начале 1930-х гг. в Институте химической физики АН
СССР были обнаружены колебания свечения в
«холодных пламенах», аналогичные колебательной
люминесценции паров фосфора, которые
заинтересовали известного физика
Д.А.Франк-Каменецкого, объяснившего эти
колебания на основании кинетической модели
Лотки. А в 1947 г. в том же институте была
представлена к защите диссертация на тему «К
теории периодического протекания гомогенных
химических реакций», написанная И.Е.Сальниковым
под научным руководством Франк-Каменецкого. Эта
диссертация содержала обширную информацию о
более чем вековой истории изучения химических
колебаний и первые результаты по их
теоретическому исследованию методами теории
нелинейных колебаний, развиваемой школой
академика Андронова. Но защита ее тогда не
состоялась. По мнению Вольтера, «работы
Франк-Каменецкого и Сальникова по химическим
автоколебаниям, изложенные в диссертации, в
книге и в ряде статей, безусловно, были
новаторскими для тогдашней химической науки. Но
это новаторство мало кто понимал.
“Колебательная идеология” (термин Андронова)
была чужда неколебательной обыденности
химической науки и практики, и этим можно
объяснить тот факт, что работы Франк-Каменецкого
и Сальникова в 1940-е гг. были приняты в штыки, а
когда состоялось вторичное открытие химических
колебаний, их никто не вспомнил». Остается
загадкой, имел ли представление об этих работах
Белоусов. Во всяком случае, в его двух статьях не
приводится ссылок на работы его
предшественников.
Реакция Белоусова
и выяснение ее механизма
Вернемся к рассмотрению сути гомогенной
колебательной реакции. Белоусов использовал
лимонную кислоту, а в качестве пары
окислитель–восстановитель – производные церия.
Ученик и сотрудник Белоусова А.П.Сафронов
посоветовал добавить в раствор комплекс железа с
фенантронилом. В этой ситуации окраска эффектно
изменялась: с лилово-красной – в ярко-синюю.
Жаботинским, который занялся подробным
изучением механизма реакции, было окончательно
показано, что автоколебательная реакция может
осуществляться и в том случае, когда лимонная
кислота заменена любой другой дикарбоновой
кислотой с активной метиленовой группировкой, а
каталитическая редокс-пара Ce(IV)/Ce(III) заменена
парой Mn(III)/Mn(II) или, как уже использовалось
Белоусовым, парой ферроин/ферриин. Наиболее
изящно, эстетически зрелищно выглядела колба,
если использовали малоновую кислоту, а вместо
ионов церия ионы железа Fе2+. Тогда раствор в колбе
может часами со строгой периодичностью изменять
цвет во всем видимом диапазоне от
рубиново-красного до небесно-голубого.
Брутто-формула реакции выглядит достаточно
просто, однако реакция протекает более чем в 20
стадий и соответственно с образованием такого же
количества промежуточных продуктов. Рассмотрим
более подробно именно эту реакцию.
Для того чтобы ее осуществить, готовят два
раствора – А и Б.
А – раствор ферроина, комплекса железа(II) с о
-фенантролином
(phen) – 2+ :
Fe 2+ + 3phen = 2+ .
Раствор может быть приготовлен заранее.
Б – раствор броммалоновой кислоты (готовится
непосредственно перед демонстрацией):
Образующаяся броммалоновая кислота
неустойчива, однако некоторое время ее можно
хранить при низкой температуре.
Для непосредственной демонстрации опыта на
стеклянную пластинку, закрывающую световое окно,
ставят чашку Петри, в которую последовательно
вносят с помощью пипеток насыщенный раствор
бромата калия, раствор броммалоновой кислоты и
раствор ферроина. В течение нескольких минут на
красном фоне в чашке появляются голубые участки.
Это обусловлено образованием другого комплекса
ферриина 3+ при
окислительно-восстановительной реакции
комплекса ферроина 2+ с
бромат-ионами:
![]()
Этот процесс протекает с автоускорением. Затем образующийся комплекс 3+ окисляет броммалоновую кислоту с образованием бромид-ионов:
4 3+ + BrCH(COOH) 2 + 7H 2 O
=
4 2+ + 2CO 2 + 5H 3 O+ + Br – + HCOOH.
Выделяющиеся бромид-ионы являются
ингибиторами реакции окисления комплекса
железа(II) бромат-ионами. Только когда
концентрация 2+ становится
достаточно высокой, ингибирующее действие
бромид-ионов преодолевается, и снова начинают
протекать реакции получения броммалоновой
кислоты и окисления комплекса. Процесс
повторяется снова, и это отражается в окраске
раствора. От голубых участков в чашке во все
стороны расходятся концентрические круговые
красно-голубые «волны» окраски.
Если содержимое чашки перемешать стеклянной
палочкой, то раствор на непродолжительное время
станет одноцветным, а потом периодический
процесс повторится. В конце концов реакция
прекращается из-за выделения диоксида углерода.
Можно внести в чашку Петри помимо всех
перечисленных реагентов несколько кристалликов
гексагидрата нитрата церия(III), тогда диапазон
окрасок расширится: появится желтый цвет за счет
производных церия(IV) и зеленый из-за наложения
голубого и желтого цветов.
Математическое описание этих процессов
оказалось достаточно сложным. Оно привело к
неожиданным результатам. Выяснилось, что одна из
простейших химических схем, описывающих
колебания в системе двух последовательных
автокаталитических реакций, математически
тождественна уравнениям, которые итальянский
ученый В.Вольтерра в начале 1930-х гг. использовал
для описания экологических процессов. В
настоящее время это известная модель
Лотки–Вольтерры, которая описывает
периодические изменения численности «жертвы» и
«хищника» в экологических системах.
С.П.Муштакова, профессор Саратовского
государственного университета им.
Н.Г.Чернышевского, рассматривает колебательную
реакцию как взаимодействие двух систем, одна из
которых черпает необходимую ей для развития
энергию, вещество или другие компоненты из
другой. Такая задача называется задачей о
хищниках и жертвах.
Для наглядности представим, что в некоторой
ограниченной среде обитают волки и зайцы. В
данной экологической системе растет трава,
которой питаются зайцы, в свою очередь
являющиеся пищей для волков. Как известно, если
иметь любую совокупность живых существ, то при
благоприятных условиях их популяция будет
увеличиваться неограниченно. На самом деле
внешние факторы, например недостаток энергии или
пищи, такой процесс разрастания ограничивают.
Представим, что до определенного момента
взаимодействие двух подсистем, т. е. популяций
волков и зайцев, было сбалансированным: зайцев (с
учетом их естественного пополнения) как раз
хватало, чтобы прокормить определенное число
волков. Затем в момент, принимаемый за нуль
отсчета времени, из-за какой-то флуктуации число
зайцев возросло. Это увеличило количество пищи
для волков и, стало быть, их число. Возникла
флуктуация численности волков. Причем
количество волков и зайцев будет меняться во
времени периодически около некоторого среднего
(равновесного) значения. Сытые волки начинают
усиленно размножаться, давая новое потомство,
которое на обильной пище быстро взрослеет и дает
новый приплод. Складывается ситуация, когда
«зайчатник» уже не в состоянии прокормить всех
волков – численность зайцев начинает падать, а
волков (до поры) продолжает расти. Наконец
экосистема перенаселена волками, а зайцам место
чуть ли не в Красной книге. Но, став экологической
редкостью, зайцы становятся трудной добычей для
волков. Экосистема вступает в следующую фазу:
численность зайцев уже упала до минимального
уровня, при котором они практически неуловимы
для волков. Поголовье последних, пройдя через
максимум, начинает сокращаться, и это сокращение
продолжается до тех пор, пока не будет достигнут
такой его уровень, который в состоянии
прокормить зайцы при своей минимальной
численности. Теперь, когда численность волков
достигла минимума, некому охотиться и за зайцами.
Зайцы начинают плодиться, а скудному волчьему
поголовью за ними уже не уследить. Численность
зайцев в короткий срок достигнет уровня, при
котором они будут в состоянии прокормиться
травой. Вновь возникает изобилие зайцев.
Какие же выводы можно сделать из сопоставления
этого примера и колебательной реакции?
Отметим основные моменты, без которых описанный
колебательный процесс был бы невозможен.
Во-первых
, кооперативное поведение
молекул в растворе невозможно без обратной
связи. Смысл последней можно понять на примере
взаимодействия зайцев и волков: увеличение числа
особей хищника ведет к уменьшению популяции
жертв, и наоборот. Наличие такой обратной связи
обеспечивает устойчивое существование
экосистемы. Если описывать колебательные
химические реакции в терминах «хищник–жертва»,
то роль «хищников» выполняют промежуточные
продукты, которые замедляют или совсем блокируют
отдельные стадии процесса, – ингибиторы. Роль
«жертв» выполняют катализаторы, которые
ускоряют ход реакции. Хотя, как известно, сами
молекулы катализатора (Fе) не расходуются в
реакции, но соотношение концентраций ионов /,
как показали исследования, претерпевает сложную
эволюцию. Эта упрощенная схема позволяет в общих
чертах представить молекулярный механизм
обратной связи в растворе.
Во-вторых
, колебательный процесс
невозможен без источника энергии, роль которого
в модели Лотки–Вольтерры выполняла трава,
которую поедали зайцы. Очевидно, что ни о каких
колебаниях и тем более устойчивости цикла
«хищник–жертва» не может быть и речи, если в
заповеднике забетонировать всю территорию –
волки съедят зайцев и потом сами вымрут. В
реакции Белоусова–Жаботинского источником
энергии служит органическая малоновая кислота.
Действительно, при ее полном окислении колебания
в реакции затухают, а затем и сама реакция
прекращается.
К 1963 г. основной качественный этап изучения
реакции Белоусова был завершен. Ученый об этом
знал, но включаться в работу он так и не захотел. В
1966 г., в марте, был созван 1-й Всесоюзный симпозиум
по колебательным процессам в химии и биохимии.
Центральное место занимали доклады Жаботинского
и его соавторов – М.Д.Корзухина, В.А.Вавилина.
Белоусов от участия в симпозиуме отказался.
Значительно позже, в 1974 г., профессором химии и
биологии Аризонского университета (США)
А.Т.Уинфри были открыты
пространственно-временные структуры в
неперемешиваемой БЖ-системе, возникающие и
существующие в виде различных дву- и трехмерных
пространственных рисунков (например,
концентрических колец, спиралей, волновых
фронтов и т. п.). С тех пор интерес к таким системам
постоянно растет, указывая на перспективность
исследований в данном направлении.
Так, все больший удельный вес приобретают
исследования прикладной направленности,
например, в области моделирования
альтернативных средств обработки информации (в
частности, анализ сложных мозаик с градацией
яркости объектов). Еще одним новым направлением
прикладных исследований является изучение
особенностей полимеризации в БЖ-системе или
сходных с ней.
Сложной пространственно-временной организации,
проявляемой БЖ-системой в отсутствие
перемешивания, со временем нашлись аналогии в
природе, в биологических системах (например,
изучение фибрилляции сердечной мышцы с точки
зрения рассмотрения миокарда как
самоорганизующейся биологической системы).
К настоящему времени реакция
Белоусова–Жаботинского заняла достойное место
в мировой науке. Она фактически стимулировала
появление новой ее области – синергетики
(самоорганизации), а экспериментальные работы
инициировали развитие современной теории
динамических систем. Хотя в настоящее время
многое в таких реакциях уже понятно, однако
причины, вызывающие колебательные химические
процессы, остаются до конца невыясненными.
Динамическое описание колебательных химических
реакций может оказать в этом существенную
помощь, в частности косвенным путем установить
недостающие константы скоростей реакций.
Фундаментальные изменения в естествознании,
породившие так называемую теорию
самоорганизации, обусловлены в значительной
степени начальным импульсом, приданным ей
российскими учеными на рубеже 1950–1960-х гг., когда
Белоусов открыл окислительно-восстановительную
химическую реакцию. При этом были обнаружены
поразительные аналогии, оказалось, что многие
природные явления, начиная от образования
галактик до смерчей, циклонов и игры света на
отражающих поверхностях, по сути дела, –
процессы самоорганизации. Они могут иметь самую
различную природу: химическую, механическую,
оптическую, электрическую и др.
В настоящее время кинетика колебательных
реакций – бурно развивающаяся отрасль знаний,
возникшая на стыке химии, биологии, медицины,
физики, математики.
ЛИТЕРАТУРА
Вольтер Б.В.
Легенда и быль о химических
колебаниях. Знание – сила, 1988, № 4, с. 33–37; Жаботинский
А.М.
Концентрационные колебания. М.: Наука, 1974,
179 с.;
Шноль С.Э.
Герои, злодеи, конформисты
российской науки. М.: Крон-Пресс, 2001, 875 с.;
Муштакова С.П.
Колебательные реакции в
химии. Соросовский образовательный журнал, 1997,
№ 7, с. 31–37;
Вавилин В.А.
Автоколебания в жидкофазных
химических системах. Природа, 2000, № 5, с. 19–25.
БЕЛОУСОВ Борис Павлович (19.II.1893–12.VI.1970) – советский химик. Родился в Москве в семье банковского служащего, шестой ребенок в семье. Вместе с братьями рано был вовлечен в революционную деятельность и в возрасте 12 лет арестован. Его матери предложили на выбор: либо сибирская ссылка, либо эмиграция. Семья оказалась в Швейцарии в большевистской колонии. Будущему ученому довелось играть в шахматы с В.И.Лениным. Борис удивлялся его азарту, тому, как он всячески поносит своего противника, пытаясь его деморализовать. На этом для Белоусова революционно-политическая деятельность закончилась. В партию он так и не вступил. В Цюрихе началось его увлечение химией, но возможности получить образование не было, поскольку надо было платить за обучение. В начале первой мировой войны Борис вернулся в Россию, желая добровольно вступить в армию, но по состоянию здоровья его не взяли.
Белоусов поступает на работу в химическую лабораторию металлургического завода Гужона (ныне завод «Серп и молот»). Лабораторию эту идейно возглавлял В.Н.Ипатьев, что предопределило направление исследований будущего ученого: разработка способов борьбы с отравляющими веществами, составы для противогазов.
Став военным химиком, Белоусов с 1923 г. по рекомендации академика П.П.Лазарева преподает химию командирам Красной Армии в Высшей военно-химической школе РККА (Рабоче-крестьянская Красная Армия, 1918–1946), читает курс лекций по общей и специальной химии в школе усовершенствования командного состава РККА. В 1933 г. Белоусов – старший преподаватель Военной Краснознаменной академии химической защиты имени С.К.Тимошенко.
Специфика научной деятельности Белоусова была такова, что ни один из его научных трудов никогда и нигде не был опубликован. Академик А.Н.Теренин назвал Белоусова выдающимся химиком. В его отзыве, написанном в связи с возможностью присуждения Белоусову докторской степени без защиты диссертации, отмечается, что «Б.П.Белоусовым начато совершенно новое направление газового анализа, заключающееся в изменении цвета пленочных гелей при сорбции ими активных газов. Задача заключалась в создании специфических и универсальных индикаторов на вредные газообразные соединения с обнаружением их в исключительно малых концентрациях. Эта задача была блестяще выполнена… был разработан ряд оптических приборов, позволяющих автоматически или полуавтоматически производить качественный анализ воздуха на вредные газы… В этой группе работ Б.П.Белоусов проявил себя как ученый, по-новому ставящий проблему и решающий ее совершенно оригинальным путем. Помимо этих исследований Б.П.Белоусову принадлежит ряд столь же оригинальных и интересных научных работ, которые не оставляют сомнения в том, что он безусловно заслуживает присуждения ему степени доктора химических наук без защиты диссертации». Непростой характер Бориса Павловича проявился и здесь, он «не хотел никаких дипломов».
Тем не менее военному химику Белоусову было присвоено звание комбрига, эквивалентное званию генерал-майора. Правда, в 1935 г. он уходит в долгосрочный отпуск, а в 1938 г. подает в отставку. Этим, возможно, объясняется то, что сам Белоусов не пострадал в период массовых репрессий 1937–1938 гг. Однако потеря многих сослуживцев и друзей наложила неизгладимый отпечаток на его характер. Неизвестно точное название секретного медицинского института, в котором работал в последующие годы Белоусов. Но, по словам сослуживцев, у него были замечательные открытия в области создания препаратов, снижающих влияние радиации, его ценили: не имея все-таки высшего образования, ученый заведовал лабораторией и по письменному указанию И.В.Сталина получал оклад доктора наук.
Проанализировав циклические реакции, открытые в послевоенные годы биохимиками, Белоусов решил осуществить химическую аналогию биологических циклов. Исследуя окисление лимонной кислоты броматом в присутствии катализатора, он обнаружил концентрационые колебания реагентов – так была открыта колебательная реакция. В 1951 г. и 1955 г. Белоусов предпринимает попытки опубликовать свое открытие в журналах «Кинетика и катализ» и «Журнал общей химии»». Отзывы на его статьи были категорично отрицательные и, как потом выяснилось, столь же категорично ошибочными. Известно, что это так повлияло на ученого, что он просто выбросил лабораторную пропись реакции и забыл о ней.
Через несколько лет, когда биохимики заинтересовались открытой Белоусовым реакцией, ему пришлось искать исходные компоненты и их пропорции путем последовательного перебора. Можно сказать, что открытие было сделано Белоусовым дважды – первый раз случайно, второй раз в результате системного поиска. Но активно участвовать в работе научного коллектива он больше не хотел. Все, что удалось коллегам, это уговорить Белоусова еще раз попытаться опубликовать свою статью. В результате единственная прижизненная публикация ученого появилась в «Сборнике рефератов по радиационной медицине» за 1958 г.
Но и когда пришло признание и международное научное сообщество назвало колебательную реакцию именем Белоусова–Жаботинского, попытки привлечь отставного комбрига к ее дальнейшему изучению были безуспешными. Те, кто его знал в последние годы, утверждали, что творческая активность Белоусова оставалась очень высокой. Он покинул институт незадолго до своей смерти – 12 июня 1970 г. До присуждения Белоусову Ленинской премии оставалось 10 лет.
Сущность колебательных реакций. Механизм и кинетика колебальных реакций.
Содержание
- ВВЕДЕНИЕ…………………………………………………………...……..…3
- Основные понятия….………………………………………………………4
- История…………………………..…………………………………………5
- Значимость и область применения…………………….……….…………8
- Механизмы реакций………………………………………………………10
- Кинетика колебательных реакций…………………………………….…14
- Порядок проведения эксперимента………………………..…………….15
- Экспериментальные данные…………………………………….……….18
- Заключение………………………………………………………………..23
- Список литературы …………..………………………………..…………24
ВВЕДЕНИЕ
Колебательные реакции являются одним из самых интересных и притягивающих разделов неорганической химии. Привлекающие пристальное внимание не только химиков, но и физиков, математиков, биофизиков и многих других, они являются актуальным вопросом современной науки. Поэтому в своей работе я хочу ознакомится с историей колебательных реакций, их практическим применением и двумя самыми известными гомогенными колебательными реакциями, а также разобраться в их механизмах и, поставив эксперимент, познакомиться с колебательными реакциями на практике.
Основные понятия колебательных реакций
- Колебательные реакции - класс окислительно-восстановительных реакций, характеризующийся периодическими колебаниями промежуточных веществ и как следствие колебаниями окраски, температуры, скорости протекания и др.
- Каталитические
- Гомогенные
- Реакции катализируемые ферментами
- Реакции катализируемые ионами металов
- Гетерогенные (реакции на твердых катализаторах)
- Некаталитические, хотя называть их автокаталитическими более правильно (окисление ароматических соединений броматом)
- Индукционный период - время первичного образования и накопления катализатора реакции.
- Период колебания - наименьший промежуток времени, за который совершается одно полное колебание (то есть система возвращается в то же состояние, в котором она находилась в первоначальный момент, выбранный произвольно)
Историю колебательных реакций нередко начинают с немецкого химика и отчасти натурфилософа Фридлиба Фердинанда Рунге. В 1850 и 1855 г. он последовательно выпустил две книги, в которых были описаны красочные периодические структуры, возникающие на фильтровальной бумаге, когда на неё наливают один за другим растворы различных веществ. Собственно одна из них -«Вещество в стремлении к формированию» представляла собой «альбом с наклеенными листами фильтровальной бумаги, на которой были произведены соответствующие реакции. Например, фильтровальная бумага пропитывалась раствором медного купороса, просушивалась и вновь пропитывалась раствором фосфорнокислого алюминия, на её в середину наносились капли железисто-синеродистого калия, после чего наблюдалось образование периодических наслоений». После Рунге в историю колебательных реакций вступает Рафаэль Лизеганг. В 1896 г. он публикует свои опыты с ритмическими структурами (кольцами Лизеганга), получающимися при отложении осадка бихромата серебра в желатине. Лизеганг наливал на стеклянную пластину нагретый раствор желатина, содержащий бихромат калия. Когда раствор застывал, он наносил в центр пластины каплю раствора азотнокислого серебра. Осадок бихромата серебра выпадал не сплошным пятном, а концентрическими окружностями. Лизеганг, знакомый с книгами Рунге, первоначально склонялся к натурфилософскому и организмическому объяснению полученного им периодического процесса. При этом он положительно отреагировал и на физическое объяснение своих «колец», данное в 1898 г. Вильгельмом Оствальдом, что базировалось на понятии о метастабильном состоянии. Это объяснение вошло в историю как теория пересыщения.
До сих пор речь шла не о собственно колебательных химических реакциях, а скорее о периодических физико-химических процессах, где химическое превращение сопровождалось фазовым переходом. Ближе к собственно химическим колебаниям подошёл Давид Альбертович Франк-Каменецкий, который начал публиковать свои опыты о химических колебаниях с 1939 г. Он описал периодические явления при окислении углеводородов: если, например, через турбулентный реактор пропускать смеси высших углеводородов, то наблюдаются периодические вспышки (пульсации) холодного пламени.
В 1949 г. в «Журнале физической химии» была опубликована большая статья И.Е. Сальникова, подводящая итог его работе, начатой совместными исследованиями с Д.А. Франк-Каменецким. В этой статье было сформировано понятие о термокинетических колебаниях. В ходе этих колебаний изменяется температура, и их необходимым условием является баланс между выделением тепла и его диссипацией в окружающую среду. И всё же самым весомым аргументом в пользу химических колебаний была статья Бориса Павловича Белоусова, которую он дважды безуспешно пытался опубликовать - в 1951 и 1955 годах. Хотя термокинетические колебания протекают в гомогенных системах (в отличие, скажем, от систем Лизеганга или осциллирующего хрома), их обеспечивает физический (или физико-химический) процесс термокатализа. Открытие Б.П. Белоусова практически завершило почти 150-летний поиск колебательных режимов в химических процессах. Она являлась уже чисто химической колебательной реакцией. В 1950-е гг., однако, происходили и другие события, относящиеся к реакции Белоусова. Ведь хотя статья Б.П. Белоусова была отвергнута, информация о его реакции распространялась на уровне научного фольклора.
Одним из реципиентов этой информации оказался Симон Эльевич Шноль, что уже тогда занимался периодическими процессами в биохимии. Его интересовала природа химической периодичности. Получив в 1958 г. от Белоусова рукопись его статьи, Шноль стал экспериментировать с его реакцией. А в 1961 г. он поручил своему аспиранту Анатолию Марковичу Жаботинскому продолжить работу Б.П. Белоусова, и тот, проводя исследования сначала под руководством Шноля, а потом независимо от него, внёс решающий вклад в выяснение кинетики реакции Белоусова и в её математическое моделирование. В результате чего эта реакция стала называться реакцией Белоусова-Жаботинского.
Механизмы реакций
На сегодняшний день изучено несколько десятков гомогенных и гетерогенных химических реакций. Исследование кинетических моделей таких сложных реакций позволило сформулировать ряд общих условий, необходимых для возникновения устойчивых осцилляций скорости реакций и концентраций промежуточных веществ:
- Устойчивые колебания возникают в большинстве случаев в открытых системах, в которых есть возможность поддерживать концентрации участвующих реагентов постоянными.
- Колебательная реакция должна включать в себя автокаталитические и обратимые стадии, а также стадии, которые ингибируются продуктами реакции.
- Механизм реакции должен включать стадии с порядком выше первого.
3HOOC(OH)C(CH 2 COOH) 2 + BrO 3 - Ce(3+/4+), H+
→ Br - + 3CO 2 + 3H 2 O
Реакция Белоусова-Жаботинского первая из открытых и исследованных колебательных реакций. В связи с чем, ее, пожалуй, можно назвать одной из наиболее исследованных реакций этой группы. На данный момент тем или иным способом подтверждено наличие восьмидесяти промежуточных стадий (и побочных реакций) протекающих в системе.
Одной из самых первых и простых схем реакций была схема, которая состоит из двух стадий:
- Окисление трехвалентного церия броматом
- И восстановление четырехвалентного церия лимонной кислотой
Она, однако, не дает понимания того, как и в следствии чего возникают колебания в системе, что приводит нас к рассмотрению механизма реакции предложенного, в 1972г, Нойесом и другими:
- BrO 3 - + Br - + 2H + ↔ HBrO 2 + HBrO
- HBrO 2 + Br - + H + ↔ 2HBrO
- HBrO + Br - + H + ↔ Br 2 + H 2 O
- Br 2 + HOOC(OH)C(CH 2 COOH) 2 → Br - + H + + HOOC(OH)C(CHBrCOOH)CH 2 COOH
- BrO 3 - + HBrO 2 + H + ↔ 2BrO 2 . + H 2 O
- BrO 2 . + Ce 3+ + H + → HBrO 2 + Ce 4+
- 2HBrO 2 ↔ BrO 3 - + HBrO + H +
- HBrO + HOOC(OH)C(CH 2 COOH) 2 → H 2 O + HOOC(OH)C(CHBrCOOH)CH 2 COOH
- 18Ce 4+ + HOOC(OH)C(CH 2 COOH) 2 + 5H 2 O → 18Ce 3+ + 6CO 2 + 18H +
Итак, рассмотрим колебания Ce 3+ / Ce 4+ в этой системе. Допустим у нас есть небольшое, постепенно увеличивающееся количество Ce 4+ в растворе, что значит, что концентрация Br - также невелика и растет за счет реакции (10). Поэтому, как только будет достигнута некоторая критическая концентрация Ce 4+ , концентрация Br - резко возрастет, что приведет к связыванию HBrO 2 стадия (2), необходимой для каталитического окисления Ce 3+ , стадии (5), (6). Из этого следует, что прекратится накопление Ce 4+ в растворе и его концентрация будет уменьшаться по реакциям (9), (10). Высокая концентрация Br - вызовет увеличение скорости их расхода по реакциям (1)-(3). При этом, после снижения концентрации Br - ниже определенного значения, практически остановит реакции (2) и (3), приводя к накоплению HBrO 2 . Из чего следует повышение концентрации Ce 4+ и повтор пройденного нами цикла.
Реакция Бриггса-Раушера:
IO 3 - + 2H 2 O 2 + H + + RH Mn(2+/3+)
→ RI + 2O 2 + 3H 2 O
Где RH- малоновая кислота, а RI- йодопроизводная малоновой кислоты.
Данная реакция была открыта в 1973г . Суть реакции состоит в окислении малоновой кислоты иодат-ионами в присутствии перекиси водорода и катализатора (ионов Mn 2+/3+). При добавлении в качестве индикатора крахмала наблюдаются колебания окраски раствора из беcцветной в желтую, а затем в синюю, вызванные колебаниями концентраций йода. Полное изучение механизма реакции Бриггса-Раушера сложная и до сих пор не решенная, пожалуй, в первую очередь, кинетическая задача. По современным представлениям, механизм данной реакции включает в себя до тридцати стадий. При этом, чтобы понять причины колебаний достаточно рассмотреть упрощенный механизм реакции, состоящий из одиннадцати нижеприведенных стадий:
- IO 3 - + H 2 O 2 + H + → HIO 2 + O 2 + H 2 O
- IO 3 - + HIO 2 + H + ↔ 2IO 2 . + H 2 O
- HIO 2 + H 2 O 2 → HIO + O 2 + H 2 O
- IO 2 . + Mn 2+ + H 2 O ↔ HIO 2 + MnOH 2+
- 2HIO + H 2 O 2 → 2I - + 4O 2 + 4H +
- MnOH 2+ + I - + H + ↔ I . + Mn 2+ + H 2 O
- HIO+ I - + H + ↔ I 2 + H2O
- 2HIO 2 → IO 3 - + HIO + H +
- RH↔ enol
- HIO + enol → RI + H2O
- I 2 + enol → RI + I - + H +
Итак, если концентрация I - мала (или данные ионы отсутствуют в растворе, что соответствует начальному моменту времени), то в соответствии со стадией (5), а при дальнейших колебаниях и стадией (11), а также обратной реакцией стадии (7) они начинают накапливаться в растворе, что приводит к уменьшению (при условии наличия) концентрации I 2 . Из уменьшения концентрации I 2 следует падение скорости накопления I - . При этом, большая концентрация ионов I - вызывает большую скорость его расходования по прямой реакции стадии (7) и возросшая, было, концентрация I - вновь уменьшается приводя нас к началу данного рассуждения и повторению описанного цикла.
Кинетика колебательных реакций
Проблемы изучения кинетики являются, на данный момент, наиболее сложными, и до сих пор не решенными вопросами колебательных реакций. Ввиду большого количества взаимозависимых и параллельных процессов, протекающих в данном классе реакций, составление систем дифференциальных уравнений, дающих хотя бы приближенные значения констант скоростей промежуточных стадий, становится крайне нетривиальной задачей. И хотя сейчас существует несколько упрощенных моделей, позволяющих рассмотреть основные черты сложного поведения колебательных реакций, данная тема представляется достаточно малоизученной и потому чрезвычайно интересной для последующих поколений исследователей. При этом, несмотря на это, в этой работе этот раздел изучения колебательных реакций не получит дальнейшего развития из-за недостатка времени и средств необходимых для его изучения.Порядок проведения эксперимента
Реакция Белоусова-Жаботинского.
Реактивы: Лимонная кислота, бромат калия, сульфат церия(III), серная кислота.
Посуда: Мерный цилиндр на 50мл, термостойкие стаканы на 300мл и 100мл, стеклянная палочка, шпатель.
Оборудование: Аналитические весы, плитка.
Для проведения реакции Белоусова-Жаботинского необходимо приготовить следующие растворы и навески:
- Приготовить раствор лимонной кислоты и нагреть его до 50 о С.
- Всыпать навески бромата калия и сульфата церия (III), размешать стеклянной палочкой.
- Снять раствор с плитки.
- Добавить серную кислоту.
Реакция Бриггса-Раушера.
Необходимые реактивы, посуда и оборудование:
Реактивы: Йодат калия, серная кислота, малоновая кислота, сульфат марганца (II), крахмал, перекись водорода.
Посуда: мерный цилиндр на 50мл, 2 стакана на 500 мл, 3 стакана на 100мл, стеклянная палочка, шпатель.
Оборудование: Аналитические весы, магнитная мешалка, магнит.
Для проведения реакции Бриггса-Раушера необходимо приготовить следующие растворы:
Раствор №1:
Раствор №2:
Раствор №3
Порядок проведения эксперимента:
- Приготовить все необходимые растворы.
- В химический стакан на 500мл, в котором находится магнит налить 50мл раствора №1 и поставить на магнитную мешалку. Включить её.
- В два других стакана отмерить порознь 25мл раствора №2 и 40мл раствора №3.
- Добавить, одновременно, растворы №2 и №3 к раствору №1.
- Зафиксировать индукционный период и периоды колебаний.
Эксперимент
Реакция Белоусова-Жаботинского:
Для проведения реакции был приготовлен раствор лимонной кислоты (20г на 80мл воды). Для полного растворения лимонной кислоты раствор было необходимо нагреть на электрической плитке. Далее были приготовлены навески бромата калия (8г) и сульфата церия III(1,5г) и последовательно всыпаны в раствор лимонной кислоты. После перемешивания стеклянной палочкой аккуратно, продолжая помешивание была добавлена серная кислота, после чего зафиксированы колебания окраски белый-желтый.
| № | Период, с | Цвет | № | Период, с | Цвет |
| 1 | 23 | белый | 12 | 12 | желтый |
| 2 | 11 | желтый | 13 | 66 | белый |
| 3 | 41 | белый | 14 | 8 | желтый |
| 4 | 12 | желтый | 15 | 43 | белый |
| 5 | 71 | белый | 16 | 6 | желтый |
| 6 | 11 | желтый | 17 | 56 | белый |
| 7 | 43 | белый | 18 | 5 | желтый |
| 8 | 13 | желтый | 19 | 43 | белый |
| 9 | 19 | белый | 20 | 5 | желтый |
| 10 | 10 | желтый | 21 | 56 | белый |
| 11 | 40 | белый | 22 | 4 | желтый |
Стоит, также, отметить увеличение количества выделяющегося газа при потемнении раствора.
Вывод: По зафиксированным данным можно судить о стабильном уменьшении времени нахождения в растворе четырехвалентного церия (что косвенно указывает на уменьшение pHсреды т.к. чем кислее среда, тем более сильным окислителем является церий и тем менее он устойчив).
Также обнаружена удивительная закономерность, так как во время протекания реакции колеблются не только концентрации промежуточных веществ, но и время периодов колебания (затухающее гармоническое колебание):
Реакция Бриггса-Раушера:
Для проведения реакции было приготовлено три раствора: сернокислый раствор йодата калия (с(KIO 3)=0,067 моль/л; с(H 2 SO 4)=0,053 моль/л) - 50мл, крахмальный раствор малоновой кислоты с добавлением каталитического количества сульфата марганца два (с(MnSO 4)=0,0067 моль/л; с(CH 2 (COOH) 2)=0,05 моль/л; крахмал 0,1%) - 25мл и семимолярный раствор пероксида водорода - 40мл. В химический стакан, в котором находился магнит, на 250 мл был налит раствор №1. Стакан был поставлен на, впоследствии включенную, магнитную мешалку и включено интенсивное перемешивание, чтобы смена окраски происходила резко. Затем, не прекращая перемешивание, было добавлено, одновременно и быстро, содержимое стаканов с растворами №2 и №3. Секундомером отмерено появление первого желтого окрашивания - индукционный период и начала появления голубых окрашиваний - период колебаний.
Индукционный период - 2 секунды.
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Период, с | 13 | 12 | 14 | 12 | 13 | 14 | 13 | 14 | 14 | 15 | 15 | 16 |
| № | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| Период, с | 16 | 16 | 17 | 17 | 17 | 18 | 17 | 18 | 17 | 18 | 18 | 17 |
Вывод: По мере протекания реакции наблюдается постепенное увеличение периода колебаний, что особенно хорошо заметно на графике:
Заключение
В данной работе были рассмотрены колебательные реакции и их свойства, в частности:
- Изучена область применения колебательных реакций в современном мире
- Изучена история колебательных реакций
- Разобраны механизмы двух колебательных реакций: Бриггса-Раушера
- Адаптирован механизм реакции Белоусова-Жаботинского для
- Проведен контрольный синтез, для наглядного ознакомления с колебательными реакциями.
Список использованной литературы
- Д.Гарел, О.Гарел «Колебательные химические реакции» перевод с английского Л.П. Тихоновой. Издательство «Мир» 1986 год. Стр. 13-25, 92-112.
- А.М. Жаботинский «Концентрационные автоколебания». Издательство «Наука» 1974 год. Стр. 87-89
- О.К. Первухин «Колебательные реакции. Методическое пособие». Издательство СПБГУ 1999 год. Стр. 3-11.
- С. П. МУШТАКОВА «Колебательные реакции в химии» Саратовский государственный университет им. Н.Г. Чернышевского
- «Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования фенилацетилена». Стр. 2-4.
- И.Д. Икрамов, С.А. Мустафина. «АЛГОРИТМ ПОИСКА КОНСТАНТ СКОРОСТЕЙ КОЛЕБАТЕЛЬНОЙ РЕАКЦИИ НА ПРИМЕРЕ РЕАКЦИИ БЕЛОУСОВА-ЖАБОТИНСКОГО». Башкирский химический журнал 2015г.
- Печёнкин А.А. «Мировоззренческое значение колебательных химических реакций»
- Field R. J., Koros E., Noyes R. M., Oscillations in Chemical Sistems II. Thorough Analisis of Temperal Oscillations in the Bromat-Cerium-Malonic Acid Sistem., J. Amer. Chem. Soc., 94, 8649-8664 (1972).
- Noyes R. M.,Field R. J.,Koros E., J. Amer. Chem. Soc., 94, 1394-1395 (1972).
|
Чтобы скачать работу бесплатно нужно вступить в нашу группу ВКонтакте . Просто кликните по кнопке ниже. Кстати, в нашей группе мы бесплатно помогаем с написанием учебных работ. Через несколько секунд после проверки подписки появится ссылка на продолжение загрузки работы. |
|
где а n , b n - коэффициенты разложения ф-ции c(t) в рад (амплитуды отдельных гармонич. компонент), A n - комплексные амплитуды,
w
- частота колебаний (i - мнимая единица). В общем случае амплитуды и частоты колебаний могут изменяться во времени (колебания затухающие, нарастающие, модулированные). Колебания промежут. соед. могут быть непериодическими или иметь непрерывный спектр.
Колебания промежут. соед. - относительно редкое явление, наблюдаемое в ходе нек-рых сложных р-ций. Элементарные хим. р-ции являются релаксац. процессами, обеспечивающими монотонное приближение реагирующей системы к состоянию термодинамич. . Для возникновения колебаний в ходе гомог. изотермич. р-ции необходимо наличие промежут. соед. и взаимодействие между ними. В существуют стационарные состояния, в к-рых c(i) i-го промежут. соед. не зависит от времени (с i =c 0 i). При небольших отклонениях системы от стационарного состояния изменение с i описывается суммой экспонент с комплексными показателями:
Величины
l
i =
g
i +i
w
i , наз. характеристич. числами. В неколебат. устойчивых системах
l
i отрицательны и действительны (g
i <0,
w
i =0). В этих случаях обычно вместо
l
i используют времена
t
i =1/
l
i . Если стационарное состояние достаточно близко к состоянию термодинамич. (выполняются соотношения взаимности Онсагера, см. ), то все
l
i действительны и отрицательны (). В этом случае система приближается к стационарному состоянию без колебаний. В сильно неравновесных системах
l
i могут стать комплексными числами, что соответствует появлению колебаний около стационарного состояния. При определенных значениях параметров сильно неравновесной системы ( исходных , т-ры, и т.д.) стационарное состояние может потерять устойчивость. Потеря устойчивости стационарного состояния является частным случаем бифуркации, т.е. изменения при определенном (бифуркационном) значении к.-л. параметра числа или типа разл. кинетич. режимов системы. Имеется два простейших случая бифуркации устойчивого стационарного состояния. В первом случае одно
l
i становится положительным. При этом в точке бифуркации (l
i =0) исходно устойчивое состояние становится неустойчивым или сливается с неустойчивым стационарным состоянием и исчезает, а система переходит в новое устойчивое состояние. В пространстве параметров в окрестности этой бифуркации существует область, где система обладает по крайней мере тремя стационарными состояниями, из к-рых два устойчивы, а одно неустойчиво. Во втором случае действит. часть одной комплексных характеристич. чисел становится положительной. При этом в окрестности потерявшего устойчивость стационарного состояния возникают устойчивые колебания. После прохождения точки бифуркации при дальнейшем изменении параметра количеств, характеристики колебаний (частота, амплитуда и т.д.) могут сильно меняться, но качеств. тип поведения системы сохраняется. В хим. системах неустойчивости могут возникать в результате ускорения р-ции ее продуктами или др. видов , субстратного или перекрестного ингибирования (см. ), конкуренции исходных в-в за промежут. соед. и т.п. В неизотермич. системах причиной неустойчивости может служить самоускорение экзотермич. стадий р-ции, а в электрохим. р-циях экспоненциальная зависимость скорости р-ции от . Появление простейших неустойчивостей и соответствующих кинетич. состояний системы удобно пояснить на примере ферментативной р-ции с двумя
S 1 и S 2 , один из к-рых, напр. S 1 , ингибирует Е:
S 01
D
S 1 S 02
D
S 2 S 1 +E 1
D
S 1 E S 1 E+S 2
D
S 1 E
:
P S 1 E+S 1
D
S 1 S 1 E
S 1 и S 2 могут поступать в систему извне (напр., за счет притока в проточном реакторе или путем через ) или образовываться в результате медленных гомог. р-ций S 0i
D
S i (i=1,2); так же происходит удаление продукта Р, не влияющего на ход р-ции. S 1 E, S 1 S 2 E и S 1 S 1 Е - фермент-субстратные комплексы; происходит из-за образования неактивного комплекса S 1 S 1 E. В этой системе имеется 6 динамич. переменных: и , [Е] и разл. форм фермент-субстратных комплексов, причем [Е] + ++=е - полная . Обычно e<< и e<<, поэтому можно применить и представить фермент-субстратных комплексов как алгебраич. ф-ции . В результате поведение системы можно описать двумя дифференц. ур-ниями относительно и . Удобно использовать безразмерные переменные
s 1
=/K 1 и
s 2
=/K 2 (K 1 и К 2 - Михаэлиса), параметры
a 1
и
a
2 - скорости поступления , а также безразмерные комбинации элементарных стадий
e, b, g, d,
( и безразмерное время
t
. Тогда дифференц. ур-ния принимают вид:

Рассмотрим случай, когда эта система имеет два устойчивых стационарных состояния - бистабильную систему, или триггер. Если
a
2 >>
a 1
/
e
, т.е. скорость р-ции S 02
D
S 2 очень велика по сравнению со скоростью р-ции S 01
D
S 1 и скоростью ферментативной р-ции, то постоянна и равна . В этом случае поведение системы описывается только одним ур-нием (3.1). Зависимости d
s
l /d
t
от
s 1
при разных значениях
a
1 показаны на рис. 1, а. Пунктирные кривые соответствуют бифуркац. значениям параметра
a-a
" 1 и
a
:
1 , а кривые, заключенные между ними, трижды пересекают ось абсцисс. Точки пересечения соответствуют стационарным состояниям
s
1 01 ,
s 1 02
и
s 1 03
, среднее из к-рых
s 1
02 неустойчиво и разделяет области притяжения устойчивых состояний
s
1 01

Рис. 1. Ферментативная система с тремя стационарными состояниями (биохим. триггер):
a
зависимость скорости d
s 1
/d
t
изменения безразмерной S 1 , от ее значения (s 1
) при разл. скоростях (a 1
) поступления ; пунктиром обозначены кривые, соответствующие бифуркац. значениям
a
" 1 и
a
"" 1 ;
6
- зависимость стационарных значений
s 0 1
от
a 1
;
s
1 01 и
s 1 0
3 устойчивые,
s 1 0
2 - неустойчивое стационарные состояния.
и
s 1 0
3 . На кривой зависимости стационарной
s 1 0
от
a 1
(рис. 1, б) область с тремя стационарными состояниями лежит в интервале (a
" 1 ,
a
"" 1). При прямом и обратном медленном изменении параметра
a 1
происходит движение системы по различным траекториям, т.е. гистерезис. Следует отметить, что описанную бистабильность можно получить в системе с односубстратной р-цией, к-рая ведет себя аналогично двухсубстратной р-ции с фиксир. одного из .
Чтобы система с одной переменной и бистабильностью стала колебательной, нужно превратить параметр в медленную переменную. В ферментативной системе с двумя таким параметром, естественно, является второго
s
2 . В этом случае для описания системы нужно использовать оба ур-ния (3). Относительные изменения S 2 (D
/) будут медленными по сравнению с относительными изменениями S l , если >>. При переходе к безразмерным параметрам это условие принимает след, вид:
a
1 ~
a
2 ~1,
e
<<1. На фазовой плоскости с координатами
s
1 ,
s
2 поведение системы качественно определяется взаимным расположением нуль-изоклин-кривых, на к-рых производные d
s 1
/d
t
и d
s 2 /
d
t
равны 0 (рис. 2, а). Точки пересечения нуль-изоклин соответствуют стационарным состояниям системы. Пунктиром показано положение нуль-изоклины d
s 1
/d
t
=0 при бифуркации, сопровождающейся возникновением устойчивых колебаний (автоколебаний) малой амплитуды. Этим колебаниям соответствует замкнутая траектория движения системы - т. наз. предельный цикл. Сплошными линиями показаны нуль-изоклины в ситуации, далекой от бифуркации, когда единственное стационарное состояние системы (точка О на рис. 2, а) сильно неустойчиво и окружено предельным циклом ABCD. Движению системы по этому предельному циклу соответствуют автоколебания
s 1
и
s
2 с большой амплитудой (см. рис. 2, б).

Рис. 2. Автоколебания (устойчивые колебания) в модельной ферментативной системе: a-фазовая плоскость в координатах
s 1
-
s
2 с нуль-изоклинами d
s 1
/d
t
=0, d
s
2 /d
t
=0; пунктиром показано положение нуль-изоклины d
s 1
/d
t
=0, соответствующее колебат. бифуркации, и малый предельный цикл, окружающий потерявшее устойчивость стационарное состояние О, ABCD большой предельный цикл; б - автоколебания
s 1
и
s
2 , соответствующие большому предельному циклу ABCD.
В ходе колебательных наблюдались периодич. колебания разл. формы: синусоидальные, пилообразные, прямоугольные и т.д.; модулированные, квазипериодические и стохастические. Периоды большинства колебательных лежат в диапазоне от долей секунды до десятков минут. К жидкофазным колебательным относятся, напр., Н 2 О 2 и S 2 O 4 2- , разл. в-в галогенкислородными соед., и . Хорошо изучена Белоусова - Жаботинского , идущая в водном р-ре, где НВrO 3 при переменной окисляет разл. орг. соед., в частности малоновую к-ту.
Газофазные колебательные обнаружены и исследованы при , СО и др. соединений. Во всех случаях существенны как объемные стадии р-ции, так и обрыв и зарождение цепей на стенках реактора, а также ускорение р-ций за счет разогрева системы в результате
экзотермич. стадий (тепловой ). Возможны чисто термокинетич. автоколебания, когда тепловой является единств, причиной неустойчивости. Простейшая модель термокинетич. колебаний в проточном реакторе имеет вид: В 0
:
В
:
Р+Q. Здесь в-во В поступает в проточный реактор идеального , где происходит мономолекулярная экзотермич. р-ция распада; выделяющееся тепло отводится через стенку реактора. Кинетика этой р-ции описывается двумя дифференц. ур-ниями относительно В и т-ры Т внутри реактора:

где [В 0 ] - приведенная на входе в реактор, Т 0 - т-ра стенки реактора, k - коэф. скорости обновления реакц. смеси в реакторе, h - коэф. скорости , Q - тепловой эффект р-ции, С р - при постоянном ,
r
- плотность, Е и А -
Исследования концентрационных колебаний до открытия реакции Белоусовым
Оказалось, что одна из первых публикаций по химическим колебаниям относится к 1828 г. В ней Т. Фехнер изложил результаты исследования колебаний электрохимической реакции. В 1833 г. В. Гершель публикует подобное исследование колебаний каталитической гетерогенной реакции. Наиболее интересна работа М. Розеншельда, относящаяся к 1834 г. Ее автор совершенно случайно заметил, что небольшая колба, содержащая немного фосфора, в темноте испускает довольно интенсивный свет. В самом факте свечения фосфора не было ничего удивительного, но то, что это свечение регулярно повторялось каждую седьмую секунду, было интересно. В публикации Розеншельда приводится детальное исследование мерцаний колбы. Сорок лет спустя эти эксперименты с "мерцающей колбой" продолжил француз М. Жубер (1874). Ему удалось в пробирке наблюдать периодическое образование "светящихся облаков". Еще через двадцать лет также немецкий ученый А. Центнершвер исследовал влияние давления воздуха на периодические вспышки фосфора. В его экспериментах период вспышек начинался с 20 сек. и уменьшался с понижением давления. В то же время в Англии химики Т. Торп и А. Таттон наблюдали в запаянном стеклянном сосуде периодические вспышки реакции окисления триоксида фосфора.
Особенно яркая страница в истории химических колебаний связана с так называемыми кольцами Лизеганга. В 1896 г. немецкий химик Р. Лизеганг, экспериментируя с фотохимикатами, обнаружил, что если капнуть ляписом на стеклянную пластину, покрытую желатиной, содержащей хромпик, то продукт реакции, выпадая в осадок, располагается на пластинке концентрическими окружностями. Лизеганг увлекся этим явлением и почти полвека занимался его исследованием. Нашлось и практическое его применение. В прикладном искусстве кольца Лизеганга использовали для украшения различных изделий с имитацией яшмы, малахита, агата и т. п. Сам Лизеганг предложил технологию изготовления искусственного жемчуга. И все-таки открытие Лизеганга, имевшее большой резонанс в научных химических кругах, не было первым. И до него изучали химические волны, а в 1855 г. вышла книга Ф. Рунге, в которой были собраны многочисленные примеры таких экспериментов.
Перечень подобных примеров можно продолжить. Вслед за указанными были открыты колебательные реакции на границе раздела двух фаз. Из них наиболее известны реакции на границе металл-раствор, получившие специфические названия - "железный нерв" и "ртутное сердце". Первая из них - реакция растворения железа (проволоки) в азотной кислоте - получила свое название из-за внешнего сходства с динамикой возбужденного нерва, замеченного В.Ф. Оствальдом. Вторая, вернее один из ее вариантов, - реакция разложения Н 2 О 2 на поверхности металлической ртути. В реакции происходит периодическое образование и растворение пленки оксида на поверхности ртути. Колебания поверхностного натяжения ртути обусловливают ритмические пульсации капли, напоминающие биение сердца. Но все эти реакции не привлекали особенного внимания химиков, поскольку представления о ходе химической реакции были еще достаточно смутными.
Лишь во второй половине XIX в. возникли термодинамика и химическая кинетика, положившие начало специфическому интересу к колебательным реакциям и методам их анализа. И в то же время именно развитие равновесной термодинамики послужило на первых порах тормозом при изучении подобных процессов. Дело, видимо, было в "инерции предыдущего знания". По словам профессора Шноля, "не мог образованный человек представить себе в беспорядочном тепловом движении огромного числа молекул макроскопическую упорядоченность: все молекулы то в одном, то в другом состоянии! Будто признать существование вечного двигателя. Этого быть не может. И в самом деле не может этого быть. Не может быть вблизи состояния равновесия, а только его и рассматривала термодинамика тех лет. Однако никаких ограничений на сложные, в том числе колебательные, режимы нет для неравновесных химических систем, когда реакции еще не завершились, и концентрации реагентов не достигли равновесного уровня. Но это обстоятельство ускользало от внимания химиков… Потребовалось чрезвычайное интеллектуальное напряжение, чтобы вырваться из "железных оков полного знания" и исследовать поведение систем вдали от равновесия".
Тем не менее уже в 1910 г. итальянец А. Лотка на основе анализа системы дифференциальных уравнений предсказал возможность колебаний в химических системах. Однако первые математические модели соответствовали только затухающим колебаниям. Лишь через 10 лет Лотка предложил систему с двумя последующими автокаталитическими реакциями, и в этой модели колебания уже могли быть незатухающими.
Однако позиции физиков и химиков здесь разошлись. Одно из наиболее ярких достижений физики и математики XX в. - создание теории колебаний. Большие, общепризнанные заслуги принадлежат здесь советским физикам. В 1928 г. аспирант А.А. Андронов, будущий академик, выступил на съезде физиков с докладом "Предельные циклы Пуанкаре и теория автоколебаний".
В начале 1930-х гг. в Институте химической физики АН СССР были обнаружены колебания свечения в "холодных пламенах", аналогичные колебательной люминесценции паров фосфора, которые заинтересовали известного физика Д.А. Франк-Каменецкого, объяснившего эти колебания на основании кинетической модели Лотки. А в 1947 г. в том же институте была представлена к защите диссертация на тему "К теории периодического протекания гомогенных химических реакций", написанная И.Е. Сальниковым под научным руководством Франк-Каменецкого. Эта диссертация содержала обширную информацию о более чем вековой истории изучения химических колебаний и первые результаты по их теоретическому исследованию методами теории нелинейных колебаний, развиваемой школой академика Андронова. Но защита ее тогда не состоялась. По мнению Вольтера, "работы Франк-Каменецкого и Сальникова по химическим автоколебаниям, изложенные в диссертации, в книге и в ряде статей, безусловно, были новаторскими для тогдашней химической науки. Но это новаторство мало кто понимал. "Колебательная идеология" (термин Андронова) была чужда неколебательной обыденности химической науки и практики, и этим можно объяснить тот факт, что работы Франк-Каменецкого и Сальникова в 1940-е гг. были приняты в штыки, а когда состоялось вторичное открытие химических колебаний, их никто не вспомнил". Остается загадкой, имел ли представление об этих работах Белоусов. Во всяком случае, в его двух статьях не приводится ссылок на работы его предшественников.
Использованы материалы:
him.1september.ru, Википедия, журнал Природа, scholarpedia.org, hopf.chem.brandeis.edu, online.redwoods.cc.ca.us, vivovoco.rsl.ru.
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ – класс окислительно-восстановительных периодических реакций. Механизм реакции напоминает работу устройства со сдерживающей защелкой. Впервые такие реакции были обнаружены в 1951 московским химиком Б.П.Белоусовым.
Колебательные реакции протекают с участием катализатора (впервые это было обнаружено в процессе реакции при наличии ионов церия) и состоят, как правило, из двух стадий.
Необходимые условия, обеспечивающие возможность протекания таких реакций:
а) скорость первой стадии должна заметно превышать скорость второй стадии;
б) на второй стадии должно возникать соединение, тормозящее протекание первой стадии (его называют ингибитором).
Подобную реакцию можно наблюдать при смешении водных растворов соли церия(III) (например, сульфат церия), бромата калия KBrO 3 и броммалоновой кислоты HO(O)C – CH(Br) – C(O)OH. Реакционную массу подкисляют серной кислотой.
На первой стадии ион трехвалентного церия (возникший при диссоциации соли церия) восстанавливается бромат-анионом (его поставляет бромат калия). При этом ион Се(III) окисляется до Се(IV), что внешне заметно по изменению окраски реакционного раствора – ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску.
10Ce 3+ + 2BrO 3 – + 12H + = 10Ce 4+ + Br 2 + 6H 2 O (I)
На следующей стадии образовавшийся ион Се(IV) реагирует с броммалоновой кислотой, окисляя ее:
4Ce 4+ + HO(O)C – CH(Br) – C(O)OH + 2H 2 O =
4Ce 3+ + HC(O)OH + 2CO 2 + 5H + + Br - (II)
При этом церий вновь становится ионом Се(III) и может вновь участвовать в реакции I. В данном случае он играет роль типичного катализатора, участвует в реакции, но при этом не расходуется, тем не менее, без него реакция не пойдет. Расходуются в процессе реакции бромат калия и броммалоновая кислота, церий лишь передает электроны от одного реагента к другому (исходные реагенты отмечены черным цветом, а продукты реакции – красным):
Своеобразие этой реакции состоит в том, что на стадии II в качестве побочного продукта возникает бром-анион Br – . Он ингибирует, то есть тормозит стадию I, а на стадию II влияния не оказывает. В результате в реакционной системе накапливаются продукты стадии II, прежде всего, ионы Се 3+ . В определенный момент, когда этих ионов накапливается очень много, ионы брома уже не могут далее тормозить стадию I, и она проходит с высокой скоростью. В системе вновь появляются ионы Се(IV), которые далее участвуют в медленной стадии II. Таким образом, ионы брома исполняют роль спускового крючка, не позволяющего до определенного момента стартовать первой стадии. Внешне это выглядит следующим образом (ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску): реакционная масса мгновенно желтеет, а затем медленно обесцвечивается (рис. 4, стакан № 1). Цвет меняется приблизительно каждые полторы минуты, интервал времени сохраняется неизменным в течение нескольких часов. Если постепенно добавлять расходующиеся реагенты, то такие «химические часы» будут работать очень долго. При повышении температуры временнóй цикл колебательной реакции сокращается.
Существуют другие примеры колебательных реакций. В описанной выше системе ионы церия можно заменить ионами железа. Для этого используют комплекс сульфата Fe(II) с тремя молекулами фенантролина, который в водном растворе окрашен в красный цвет (этот комплекс широко используют для количественного определения железа):
Аналогичный комплекс Fe(III), появляющийся в результате окисления, окрашен в голубой цвет, в процессе реакции голубой цвет мгновенно становится красным, который вновь постепенно переходит в голубой (рис. 4, стакан № 2).
Если заменить броммалоновую кислоту лимонной [НОС(О)СН 2 ] 2 С(ОН)С(О)ОН, то в присутствии каталитических количеств солей марганца возникает система, в которой цвет пульсирует каждые две минуты (рис. 4, стакан № 3). Щавелево-уксусная кислота НОС(О)СН 2 С(О)С(О)ОН с солями церия отсчитывает шестисекундные интервалы (стакан № 4). Интервалы времени на анимированном рисунке показаны условно, самый большой интервал смены цвета в стакане № 3, самый малый – в стакане № 4
Вскоре после открытия таких реакций удалось установить, что подобные процессы достаточно распространены. В результате была разработана общая теория колебательных процессов, к которым относят некоторые газофазные реакции (например, окисление углеводородов), гетерофазное окисление монооксида углерода, водорода, аммиака, этилена на металлических катализаторах, ряд полимеризационных процессов. Колебательные реакции определяют протекание некоторых важнейших биологических процессов: генерации нервных импульсов и механизма мышечного сокращения.
Михаил Левицкий

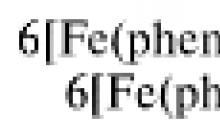







Все, что нужно знать о тельцах Мужчина телец он
Самый простой рецепт пиццы из домашнего теста и обычных продуктов Пицца на скорую руку рецепты
Чем отличается шницель от котлеты, эскалопа, бифштекса, отбивной
Аллегория – понятие, примеры из литературы, отличие от метафоры
Лев кассиль кондуит и швамбрания Кондуит и швамбрания краткое содержание по главам